
膵β細胞注1)をシート状に培養して移植する新しい糖尿病の治療法と、マイクロRNAの静脈投与による膵β細胞の再生に関する研究、加えて、ヒトiPS細胞から膵β細胞へ分化誘導して糖依存的にインスリン分泌する能力のある膵β細胞を作製する研究についてご紹介いたします。
1)糖尿病:膵β細胞 細胞シート 皮下移植 マウス 基礎研究
◎東京女子医科大学先端生命医科学研究所
同大学大橋特任准教授と福島県立医科大学後藤主任教授らは、膵臓の細胞(膵島細胞)をシート状に培養し、移植する新しい糖尿病の治療法を開発しました(2011/10/24)1),2)。マウスの実験で長期間、血糖値を正常に保つことを確認しました。膵島細胞を直接に移植する治療法よりも効果が高いということです。今後、iPS細胞と組合わせることにより、糖尿病を完全に克服する根治療法の実現につながるとみています。
ラットの膵島細胞を採取し、特殊な培養皿の上で直径2cm、厚さ15μmのシート状に培養し、糖尿病のモデルマウスの背中の皮膚の下に2枚のシートを重ねて移植し、約4カ月間、血糖値の変化を調べました。11匹すべてで移植後約3日目から血糖値が正常になり、エサを与えた後も糖尿病でよくみられるような異常な急上昇はなくなることを確認しました。移植したシートを精査すると、膵島と同じように、β細胞が円の中心部分に集まり、外側をα細胞が取り巻いていることを観察しました。β細胞は血糖値を下げるインスリンを、α細胞は血糖値を上げるグルカゴンを出します。両細胞が規則正しく存在することで血糖値が高い時は下げ、下がると自然に正常値に戻し低血糖になりすぎるのを防いでいると考えられるとしています。
同大学はカナダのアルバータ大学とも共同研究を進めており、ヒトの膵島細胞のシート培養に成功しており、今後、動物に移植して安全性と有効性を確認した上で、臨床応用を目指すとしています。また、患者さんから採取した膵島細胞を一定量まで増やすのは難しいため、iPS細胞から膵島細胞を作製し、シート化していくことも検討するとしています。
2)糖尿病:膵β細胞再生 マイクロRNA 静脈投与 マウス 基礎研究
◎東北大学大学院医学系研究科
同大学片桐教授らのチームは、糖尿病のマウスに遺伝子の働きを抑える「マイクロRNA注2)」という分子を静脈投与によって、血糖値が下げることを報告しました(2016年12月7日)3)。この研究結果は、マイクロRNAの静脈投与によるインスリン分泌細胞(膵β細胞)の再生に初めて成功したことを意味するとのことです。
最近の研究により、マイクロ RNAが標的遺伝子の発現を負に制御することにより、発生、分化、細胞の増殖、アポトーシスさらには組織再生において重要な役割を担っていることが明らかにされました。加えて、様々な細胞から分泌された細胞外小胞(エクソソーム注3)が、液性因子として生体内を循環し、内包するマイクロRNA などの核酸を他の細胞へ受け渡すことで、細胞間の情報伝達を媒介していることも明らかにされてきました。
研究チームでは、今回、骨髄移植マウスで認められた膵β細胞再生のメカニズムとして、エクソソームを介する細胞間マイクロRNA伝達が重要な役割を担っていることを発見しました。さらに、同定した2種類のマイクロRNA(マイクロRNA-106bとマイクロRNA-222)をインスリン分泌低下によって発症した糖尿病マウスに、静脈注射により投与したところ、膵β細胞が増殖することによってインスリン分泌が回復し、血糖値が改善したと報告しました。これらより、マイクロRNA-106bとマイクロRNA-222による膵β細胞の再生促進が、糖尿病の根治につながる新規治療法となる可能性が示唆されたとしています。
研究の注目点は次の通りです。
3)糖尿病:ES細胞/iPS細胞 膵β細胞 マウス 基礎研究
◎熊本大学、東京工業大学
同大学粂教授(現、東京工業大学大学院生命理工学研究科)らは、細胞質内に存在するモノアミンを小胞に取込むトランスポーターの一種Vesicular monoamine transporter 2 (VMAT2)を阻害することでES細胞から膵β細胞への分化誘導効率が高まることを世界で初めて明らかにしたと発表しました(2013年12月16日)4)。重篤な糖尿病では、移植医療が適応となりますが、ドナー不足が大きな問題点となっています。新たなインスリンの供給源として、ES細胞やiPS細胞から膵β細胞を誘導することが考えられます。
再生医療にES細胞やiPS細胞から作られる膵β細胞を利用するためには、分化誘導効率が高く、血糖値に応じてインスリンを分泌する能力があることが求められます。既往の研究ではES細胞やiPS細胞から膵前駆細胞をある程度創ることが可能になってきていますが、内分泌前駆細胞・β細胞への分化過程に関しては効率が低く、誘導されたβ細胞はグルコース濃度に応じてインスリンを分泌する機能が弱いことが問題点でした。
同研究では、低分子化合物の中から膵臓の内分泌細胞への分化を促進するVMAT2注4)を同定しました。このVMAT2を阻害すると、モノアミンが小胞に取り込まれずに、細胞質に存在する分解酵素によって分解されます。当研究の結果からVMAT2により細胞内の小胞に蓄えられているモノアミンが 膵β細胞への分化を抑制することが明らかになりました。
加えて今回の研究から、もう一つ化合物の細胞透過性cAMP注5)が膵内分泌前駆細胞から成熟なインスリン分泌能をもった膵β細胞に分化するように促進する作用があることを見出しました。これら二つの化合物を添加して得られた膵β細胞はインスリン含量、インスリン分泌能において、成体膵島の能力とほぼ同等であったそうです。これらの結果は前記の再生医療に向け細胞が満たすべき2つの条件を満たしています。糖尿病モデルのマウスへの移植実験では血糖値の改善が見られたようです。粂昭苑教授らは、2013年にヒトiPS細胞から小腸細胞を作成することに成功し、2016~2017年にはヒトiPS細胞から膵β細胞へ分化誘導し、糖依存的にインスリン分泌する能力のあるβ細胞を作るプロトコールを決定しました。
その後、東京工業大学と第一三共、三菱UFJキャピタルは、iPS細胞からインスリン産生細胞を作製し、再生医療・細胞治療への活用を目指すオープンイノベーション研究を共同で開始すると発表しました(2019年1月18日)5)。粂教授らが開発されたヒトiPS細胞から膵β細胞を高率に作製する方法6)と、第一三共(株)の技術を融合させることで、生体内の膵β細胞に近いiPS細胞由来インスリン産生細胞の作製を可能にするとしています。同研究では、iPS細胞由来のインスリン産生細胞のさらなる性能の向上、および作製法の改良を行い、従来のインスリン治療では血糖コントロールが困難でアンメットメディカルニーズが高い重症1型糖尿病に対する革新的な治療法の実用化を目指すとしています。
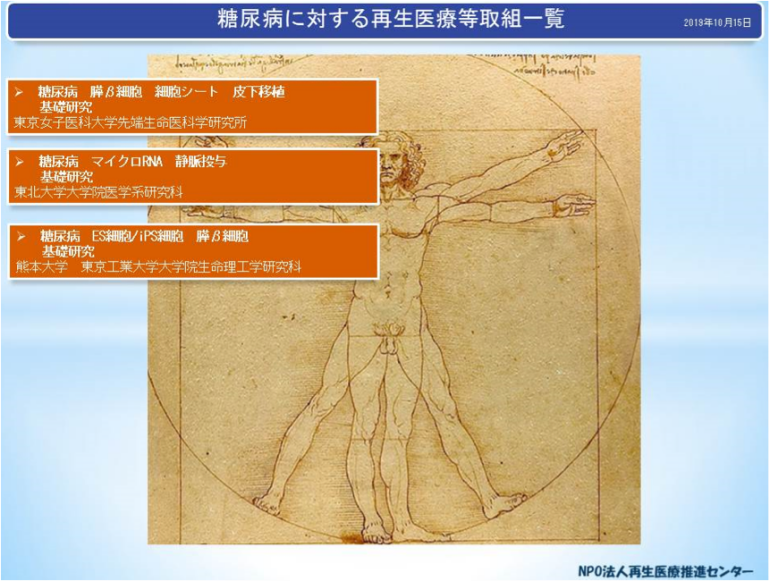
図1 糖尿病に対する再生医療等の取組(取組(2)で紹介)
(用語解説)
(参考資料)
(NPO法人再生医療推進センター 守屋好文)
プライバシーポリシー
再生医療推進センターは再生医学、再生医療の実用化を通して社会への貢献を目指す非営利活動法人です。
Copyright © NPO法人再生医療推進センター All rights reserved.