Muse細胞の研究動向については、再生医療トピックスNo.15の「Muse細胞、再生医療の現状」で取上げました。その後、本年7月9日に脊髄損傷を対象疾患としたMuse 細胞製品の臨床試験を開始するとの発表がありましたので、ご紹介いたします。なお、脊髄損傷に対する再生医療等の取組につきましては、再生医療トピックスNo.31、No.32、No.33で触れました。現在、自家骨髄幹細胞、鼻粘膜、あるいは他家iPS細胞を用いた臨床研究が開始されており、自家脂肪幹細胞、自家骨髄幹細胞を用いた治療も行われております。
◎(株)生命科学インスティテュート注2)
同社は、脊髄損傷を対象疾患として、Muse 細胞製品「CL2020」の臨床試験を国内で開始すると発表しました(2019年7月9日)1-2)。現在の脊髄損傷の治療では、運動麻痺および感覚麻痺痺の十分な改善が得られず、長期間にわたって患者さん、並びにご家族にとりましても経済的、社会的、精神的な負担となります。我が国では、年間4〜5千人が受傷し、総患者数は10〜20 万人と推計されています。このような観点から、有効な新規の治療法が期待されています。
Muse 細胞は末梢血や骨髄、および各臓器の結合組織中に分布している内因性の修復幹細胞で、遺伝子の導入や事前に分化誘導したり、外科手術で細胞を移植したりする必要もなく、そのまま静脈内に投与するだけで損傷部位に集積し、そこに生着して組織を修復するという特徴を有しています3)。同社によりますと、脊髄損傷モデルラットにCL2020を急性期から亜急性期に1回または2回静脈内投与した結果、後肢運動機能の改善効果が認められ、歩行可能となり、投与時期や投与回数が異なっていても、運動機能の改善効果が認められたとのことです。ラットの体内の脊髄が傷ついた部分からは“SOSシグナル”が出ていて、投与されたMuse細胞が、そのシグナルをキャッチして自ら傷ついた部分に移動し、新しい神経細胞になって修復したと考えられるとしています。そこで、臨床において単回投与による有効性と安全性を検討するに至ったようです。
臨床試験の概要ですが、対象疾患としては、受傷から2週間程度の亜急性期患者(16歳以上75歳未満)さんに対し、CL2020を単回静脈投与による有効性と安全性を検討します。筑波大学附属病院ほか10施設で行うことを予定し、非盲検、非対照で行い、目標の症例数は10症例としています。亜急性期を対象にした理由は、急性期の炎症が収束し、血管新生・組織修復反応が盛んに起こるためとしています。早ければ2020年度にも承認申請をしたい考えとのことです。
なお、生命科学インスティテュート社はMuse 細胞製品「CL2020」を用いて、2018年12月に「急性心筋梗塞」、同年9月に「脳梗塞」、同年12月に「表皮水疱症」注3)を対象に治験を進めています。
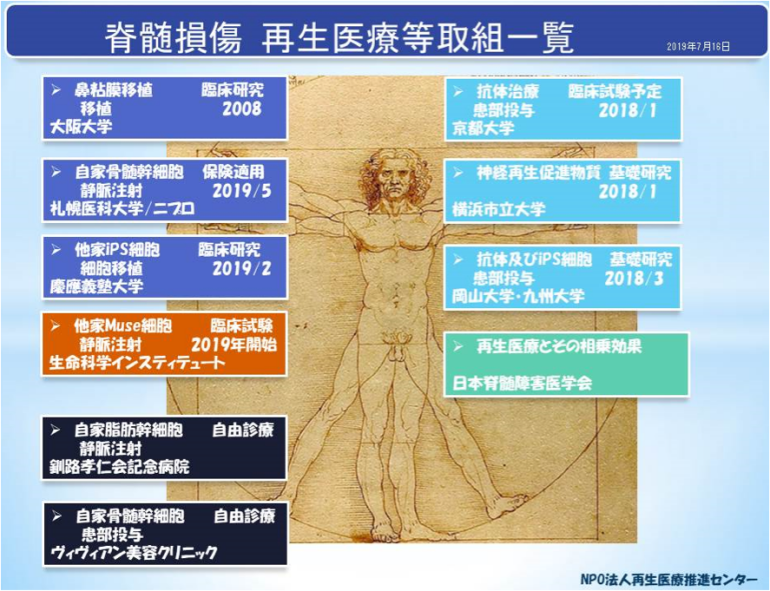
図1 脊髄損傷に対する再生医療等取組状況
(用語解説)
(参考資料)
(NPO法人再生医療推進センター 守屋好文)