
Muse細胞由来の再生医療に関しては、本再生医療トピックNo.78「Muse細胞由来の再生医療の現状:心筋梗塞、脳梗塞、亜急性期脊髄損傷、表皮水疱症、慢性腎臓病」等で取上げました。今回は、「Muse細胞製品を用いた新生児低酸素性虚血性脳症に対する治験」についてご紹介致します。先ずは、No.78再生医療トッピクスから抜粋して「幹細胞の再生医療とMuse細胞」について触れます。続いて新生児低酸素性虚血性脳症に対する治験、加えて脳梗塞の治験の結果について概要を記します。
幹細胞は組織に応じた細胞に分化できる能力と、自らを複製する能力を有しています。幹細胞には、胚性幹細胞(ES細胞)、人工多能性幹細胞(iPS細胞)、体性幹細胞(成体幹細胞、組織幹細胞)などが知られており、再生医療等に活用されています。体性幹細胞である骨髄幹細胞は1960年代に発見され1)、現在、急性移植片対宿主病、脊髄損傷の治療薬として厚生労働省より承認を得ています。また、第二種再生医療等として国に提供計画が届けられ、脳梗塞の研究などが進められています2)。
ES細胞は1981年に英国の生物科学者マーティン・エバンス氏らが、マウスの胚盤胞の内側にある細胞を取出し、それを試験管の中で培養する条件を突き止めました3)。1998年に米国のジェームズ・トムソン(iPS細胞の作製を中山教授と同日に発表)氏がヒトのES細胞を作製することに成功しました4)。国内ではES細胞から作製した肝細胞を生まれつき重い肝臓病のある乳幼児に移植する医師主導の臨床試験が進められています。
また体性幹細胞である脂肪幹細胞は、2001年に脂肪組織中の間葉系幹細胞として発見されました5)。現在、肝硬変を対象とした他家脂肪組織由来幹細胞製剤の臨床試験が進められています。脂肪幹細胞を用いた研究および治療の進展はめざましく、第二種再生医療等の治療で多くの医療機関で用いられています2)。
iPS細胞は、京都大学の山中伸弥教授によって、2006年にその作製が発表され6)、これまでも再生医療トピックスでご紹介しましたが、加齢黄斑変性、パーキンソン病、目の角膜の病気(角膜上皮幹細胞疲弊症)、重症心不全でそれぞれ移植が実施されています。
そして、2010年には東北大学の出澤教授によって新たな幹細胞が発見され、Muse細胞(Multi-lineage-differentiating Stress Enduring Cell)と名付けられました7),8)。
人の皮膚や骨髄などの中に、いろいろな組織や臓器に成長する能力を持つ新たな「多能性幹細胞」が存在することが、東北大大学院医学系研究科出澤教授らの研究グループによって明らかにされました。当該研究グループは、皮膚由来のヒト線維芽細胞や骨髄由来の骨髄間葉系細胞に長時間、低酸素や栄養がないなどのストレス条件を与えて細胞を濃縮し、これを浮遊培養したところ、人のES細胞とよく似た細胞の塊が形成されました。最初は時間と共に増殖しますが、10~14日程度で成長は停止し、無限に増えることはないとのことです。特別な処理を加えると、5代先まで自己複製できることが確認されています。ゼラチンで培養しますと、神経や平滑筋、肝臓などへ分化できることも確認されています。
Muse細胞は多能性幹細胞マーカーSSEA-3を指標に同定が可能であり、多様な細胞に分化する能力を有するとされています。傷害を受けた臓器から出されるシグナル(S1P:sphingosine-1-phosphate)を感知することで血液中のMuse細胞は傷害部位に集積し、組織を構成する複数の細胞種に分化することで傷害組織を健常組織に置き換えて修復することが報告されています。
このため、iPS細胞のように治療対象である臓器の心筋細胞、あるいは神経細胞などに事前に体外で分化誘導や増殖させる必要はなく、分化した細胞を外科的治療法で移植する必要はありません。また、Muse細胞は免疫抑制作用も有しているため、他人の細胞移植(他家移植)を行っても免疫拒絶反応のリスクを抑えることができると考えられています。Muse細胞による再生医療は、点滴による治療の可能性があります。この点滴での再生医療が可能となれば、特別の施設を有しない病院での治療も実現され、Muse細胞による治療効果の恩恵を受けることができるでしょう。
現在、国の承認を受けて(株)生命科学インスティテュートが2018年1月から他家Muse細胞による急性期心筋梗塞への治験が、同年9月からは脳梗塞患者を対象とした治験が開始されています。現在、動物実験の段階ですが、脳梗塞モデル動物において神経機能の回復や慢性肝障害モデル動物での著しい肝機能の回復などが報告されています。細胞治療が他家細胞の点滴投与によって実現できれば、現在、国に届出された提供計画に基づく治療が進められている脂肪幹細胞などと相まって再生医療は大きく進むことが期待されます。
名古屋大学医学部附属病院は、東北大学大学院と共に、新生児低酸素性虚血性脳症(neonatal hypoxic-ischemic encephalopathy;HIE)を対象疾患とするMuse 細胞製品「CL2020」の細胞を用いた臨床試験を医師主導治験として、国内で2月下旬より開始すると発表しました(2020年1月30日)10)。脳性麻痺の発症率は、出生1,000人に対し2~3人の割合です。主な原因は周産期脳障害が挙げられますが、充分な治療法がありません。
既にご紹介いましたが、Muse細胞は末梢血や骨髄、並びに各臓器の結合組織中に分布している内因性の修復幹細胞で、遺伝子の導入や事前に分化誘導したり、外科手術で細胞を移植したりする必要もなく、そのまま静脈内に投与するだけで損傷部位に集積します。Muse細胞は、そこに生着して分化をすることで、傷ついた細胞の代わりに、傷ついた組織を修復するという特徴を有しています。この度の医師主導治験では、Muse細胞の再生医療等製品CL2020の開発を進めている株式会社生命科学インスティテュートより治験製品が提供され、名古屋大学で新生児用に調製して投与する予定です。
同大学医学部附属病院の佐藤講師の研究グループは、HIEモデル動物を用いた行動学的評価において、Muse細胞の再生医療等製品を単回静脈内投与することで、運動麻痺などの障害や不安関連行動を改善する効果と安全性を確認されています。こうした研究結果から、Muse細胞の再生医療等製品の単回静脈内投与によって、障害の改善が期待されることから、同製品は新生児低酸素性虚血性脳症患児の新たな治療選択肢となり得るとしています。
(株)生命科学インスティテュートは、東北大学脳神経外科にて2018年9月から実施しておりました脳梗塞患者を対象としたMuse細胞製品(CL2020)の臨床試験について、公表されました(2020年4月23日)11)。当該試験の主要評価項目であるCL2020投与後12週までの安全性について、治験を進める上で特に問題は認められなかったとしています。副次評価項目である有効性については、目標を達成したそうです。その他の詳細については解析中であり、今後、学会または学術雑誌での公表を予定しているとのことです。
同社は、現在臨床試験が進行中の急性心筋梗塞、脳梗塞、表皮水疱症、亜急性期脊髄損傷のうちデータが揃い準備の整ったものから2020年度中に製造販売承認申請をおこなう予定としています。
Muse細胞による治療は、点滴で行われるために、患者さんの負担が比較的に少なく、中小病院でも治療が可能となります。Muse細胞は体にある細胞なので、腫瘍化の恐れは低いとされています。また、特殊な免疫調節システムも持っているので、他人の細胞をそのまま移植しても臓器移植でみられるような拒絶反応が起こらないとされています。一方、課題としては費用と供給の問題があります。わが国では現在、商用目的で提供者からMuse細胞などの幹細胞を採取し、使うことは法律で規制されていています。まったく新しい治療であり、長期的な安全性は今回の試験だけでなく、時間をかけて検証する必要があるでしょう。
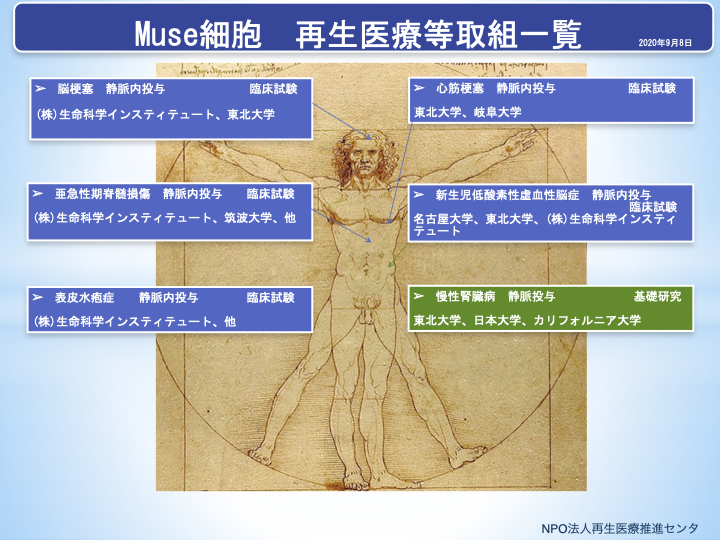
図1 Muse細胞による再生医療等臨床試験および基礎研究
(y. moriya)
プライバシーポリシー
再生医療推進センターは再生医学、再生医療の実用化を通して社会への貢献を目指す非営利活動法人です。
Copyright © NPO法人再生医療推進センター All rights reserved.