
最近、新型コロナに対してメッセンジャーRNAワクチン(mRNAワクチン)、遺伝子ワクチンという言葉を耳にされた方も少なくないでしょう。ワクチンには多くの種類があります。(1)ウイルスベクターワクチン、(2)メッセンジャーRNA(mRNA)ワクチン、(3)DNAワクチン、(4)組み換えたんぱく質ワクチン、(5)組み換えウイルス様粒子(VLP)ワクチン、(6)不活化ワクチンなどで、それぞれ誘導できる抗体の種類も異なります。
新型コロナ用のファイザーやモデルナのワクチンはメッセンジャーRNA(mRNA)ワクチンです。身体の中でタンパク質が作られる仕組みは、まず細胞の中の核にあるDNA上の遺伝情報を読み込んでmRNAが作られ、それが核外(細胞質)に出て、細胞質でアミノ酸が合成されタンパク質が作られます。mRNAワクチンは本来DNAから読み取る遺伝子情報(新型コロナの場合では、外殻の突起のタンパク質の情報)(mRNA)を体外(工場)で作ります。直ぐに分解されないよう、また過剰な免疫が誘発誘導されないようナノ粒子(LNP)に封入して筋肉注射します。LNPは細胞に取り込まれ,その細胞内で新型コロナウイルスの外殻の突起のタンパク質を作ります。その作られた“人工的”突起蛋白が細胞外に放出されますと、免疫システムが働き、突起蛋白に対する抗体を作ります。こうして新型コロナウイルスに対する免疫を獲得しようとする仕組みです。ヒトの細胞を抗原(突起蛋白)作成の工場として使うのです。
日本ではファイザーやモデルナのワクチン以外にアストラゼネカのワクチンも導入されるようですが,こちらはウイルスベクターワクチンと呼ばれるものです。これは、mRNAをLNPの代わりに、病原性のない(または弱毒性の)ウイルスを使ってヒト細胞内に送り込みます(細胞内への遺伝子情報の運び手となるウイルス(レトロウイルス、レンチウイルス、アデノウイルス、アデノ随伴ウイルス注1)、および単純ヘルペスウイルスなど)をウイルスベクターと呼ぶことがあります)。LNPを使ったmRNAワクチンと異なりベクターウイルスが細胞に感染し、その細胞内で突起蛋白をつくります。
いずれにしても新型コロナウイルスやその蛋白を注射しない点が従来のワクチンと異なる点です。注射するのはコロナウイルスの突起蛋白を作る遺伝子ですから遺伝子ワクチンと呼ばれます。遺伝子ワクチンも抗体によりウイルスを排除する「液性免疫」と、免疫細胞の1つであるキラーT細胞などにより排除する「細胞性免疫」を引き起こす点は同じです1)。
この遺伝子ワクチンの手法つまり、遺伝子情報をヒトの所定の部位の細胞に送り込んで,目的とするタンパク質を作成する手法は、ワクチン以外の分野でも研究が進められています。
私達が手足を自由に動かすことができるのは、脳の表面近くにある運動神経細胞から出された信号が脊髄を通って末梢神経に伝わりそこから筋肉に伝えられるためです。脊髄は脳と筋肉を結ぶ神経の通り道として機能しています。再生医療トピックスNo.121に記載したとおり脊髄損傷(SCI)(日本整形外科学会HPへ)2)は、事故などにより脊髄が傷つくと神経線維(軸索)が損傷し、脳からの指令が適切に筋肉に伝わらなくなるため手足が動かなくなってしまいます。
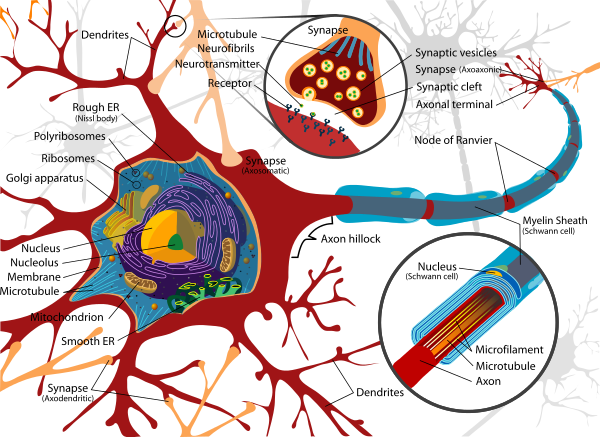
神経細胞の構造図(LadyofHats/wikipedia)
en:Dendrites=樹状突起、en:Rough ER (en:Nissl body)=粗面小胞体(ニッスル小体)、en:Polyribosomes=ポリリボソーム、en:Ribosomes=リボソーム、en:Golgi apparatus=ゴルジ体、en:Nucleus=細胞核、en:Nucleolus=核小体、en:Membrane=膜、en:Microtubule=微小管、en:Mitochondrion=ミトコンドリア、en:Smooth ER=滑面小胞体、en:Synapse (Axodendritic)=シナプス(軸索樹状突起) en:Synapse=シナプス、 en:Microtubule en:Neurofibrils=微小管ニューロフィラメント、en:Neurotransmitter=神経伝達物質、en:Receptor=受容体、 en:Synaptic vesicles=シナプス小胞、en:Synaptic cleft=シナプス間隙、 en:Axon terminal=軸索末端、en:Node of Ranvier =ランヴィエの絞輪 、en:Myelin Sheath(en:Schwann cell)=ミエリン鞘(シュワン細胞)、en:Axon hillock=軸索小丘、 en:Nucleus (en:Schwann cell)=細胞核(シュワン細胞)、en:Microfilament=マイクロフィラメント、en:Axon=軸索
成体の哺乳類の中枢神経系(CNS)の神経細胞(ニューロン)は、損傷した軸索を自然に再生することは出来ません。この再生障害は、脊髄損傷後の傍麻痺または四肢麻痺などの重度の永続的な障害を引き起こすことがよくあります。現在まで、この傷ついてしまった脊髄を治す有効な治療はまだ確立されていません。現在世界中でおおよそ540万人が脊髄損傷による麻痺を抱えていると言われています。
再生医療分野からの脊髄損傷に対する治療アプローチとしては間葉系幹細胞の静脈注射療法あるいは神経幹細胞・ES細胞・iPS細胞などを用いた細胞移植療法がありますが、神経栄養因子や軸索伸展阻害因子の阻害剤などを組み合わせた細胞移植療法以外の治療もあります。
Ruhr University of Bochum(Department of Cell Physiology)のMarco Leibingerらは、マウスで実験的に起こした脊髄損傷(SCI)部位にJAK / STAT3シグナル伝達と軸索再生を強力に刺激するデザイナーサイトカインであるハイパーIL-6(hIL-6)を発現させる遺伝子導入したアデノ随伴ウイルスベクター(AAVベクター)注2):AAV2-hIL-6を脊髄挫滅(SCC)後に感覚運動皮質に投与することによって、脊髄が完全に押しつぶされた後に両方の後肢に有意な運動回復を認めたとNature Communicationsに報告しました3)。また,この機能回復は主にセロトニン作動性線維の再生の改善に依存しているだろうことを見つけました。更に、ウイルスで発現させたhIL-6は体細胞から放出され、隣接する運動ニューロンをパラクリン様式で刺激するだけでなく、視覚系のRGCまたは皮質ニューロンの軸索で長距離輸送されることも示しました。
アデノ随伴ウイルス(AAV)は、自身の遺伝子(ゲノム)複製を細胞に依存しています。AAVは、細胞表面の外側に位置する受容体を介してヒト細胞に侵入し、細胞核に到達します。核内に到達した後、AAVはヒト第19染色体上のAAVS1とよばれる位置に特異的に組込まれます(野生型AAVはヒトゲノムに部位特異的に組込まれる唯一の真核生物ウイルスです)。
アデノ随伴ウイルス(AAV)のAAVセロタイプ2(AAV2) は、自然な状態では広範な組織に感染するものの、骨格筋、神経細胞、血管平滑筋細胞、および肝細胞といった組織種への指向性を示します。また,アデノ随伴ウイルスは80%近いヒト集団に存在し、年齢10歳の時点で世界人口の60%がAAVセロタイプ1、2、3、および5の中和抗体を保有することが報告されています。ヘルパーウイルスの協力なしではAAVは複製されないことから、ヒト宿主内ではほぼ検出不可能なまでに共生していると考えられており、現在のところ、AAVに関連する疾患は知られていません。その免疫原生が低いことは実験的に示されています。
アデノ随伴ウイルスベクターは分裂細胞と静止状態の細胞の何れにも感染でき、遺伝物質を非常に多様な細胞種に送り込むことが出来ます。野生型のAAVは宿主細胞の部位特異的に組込まれ、信頼できる挿入パターンをもつことから結果が予測しやすいことも特長です。近年では組換え型AAVは宿主ゲノムに挿入されないよう変更されてはいるものの、染色体外の状態で長期にわたり細胞内に存続することも可能です。AAVは非分裂細胞において長期発現することができ、ほぼ無視できる程度の病原性を示すとともに非常に緩やかな免疫応答を引き起こしますが、これらは全て遺伝子治療に利用する上で好ましい特性であるといえます3)。
近年、アデノ随伴ウイルスを骨格としたウイルスベクターは世界中で多くの臨床治験に利用されています。そこには、嚢胞性線維症、血友病、うっ血性心不全、リポタンパク質リパーゼ欠損症、およびパーキンソン病に対するいくつもの有望な治験が含まれています。
(adipocyte+neuron / 20210311)
プライバシーポリシー
再生医療推進センターは再生医学、再生医療の実用化を通して社会への貢献を目指す非営利活動法人です。
Copyright © NPO法人再生医療推進センター All rights reserved.