厚生労働省の研究班によりますと、国内の認知症の高齢者は推計600万人余りで、この7割近くがアルツハイマー病とされています。アルツハイマー病注1)は、日本のように人口構成において高齢化が大きな課題になっている先進国が直面している最も重要な問題の1つである認知症の主な原因です。 アルツハイマー病の原因はまだ不明ですが、脳内のアミロイド注2)沈着は有力な候補の一つです。 アミロイド沈着物を取り除くことができれば、アルツハイマー病を治療できる可能性があります。 アミロイドに対する抗体を作成し、それらを投与して疾患を治療し1)、アミロイドの形成を阻害する試みがなされてきましたが2)、これらはまだ満足のいく結果をもたらしていません。 一方、間葉系幹細胞は、いくつかの難治性疾患の効果的な治療法として期待され3)、多くの臨床研究や治療が実施されてきました。
幹細胞には異常なタンパク質を分解する能力があります。アミロイドの分解酵素の1つにネプリライシン注3)がありますが、 間葉系幹細胞はネプリライシンを分泌します4,5)。 そのため、間葉系幹細胞の投与がアルツハイマー病の効果的な治療法になるのではないかと考えられていました。
京都府立医科大学 山岸久一名誉教授(元学長)などのグループは、当ホームページの掲示板に掲載されている認知症患者9名の自家脂肪幹細胞の静脈投与による治療により得られた症状改善の知見に基づいて,その作用機序を考察した論文をMedical Hypotheses に投稿し、掲載されました(K. Shigematsu et al. 「Hypothesis: Intravenous administration of mesenchymal stem cells is effective in the treatment of Alzheimer’s disease」, Medical Hypotheses 150 (2021) 110572)。
論文では脂肪幹細胞を肺疾患患者に投与した時に“偶然“皮膚アミロイドーシスの改善が認められたことから,「間葉系幹細胞の静脈内投与された細胞はアルツハイマー病の治療に効果的だろう」と推論しています。また,この仮説を支持する世界中から投稿された多くの研究論文も紹介されています。
- 間葉系幹細胞はネプリライシンを分泌することが知られており4)、培養した幹細胞でもネプリライシン活性を確認しています。
- 自家間葉系幹細胞の静脈内投与の安全性が確立されています6,7)。 自家脂肪由来幹細胞の収集は低侵襲であり、それらの静脈内投与は反復可能です。
- 自家間葉系幹細胞で治療された患者では、皮膚アミロイド沈着物が消失しました。 これは、幹細胞由来のネプリライシンが体内でアミロイドを分解する働きをするという考えを強く支持しています。 このケースを以下に示します。
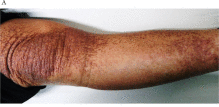
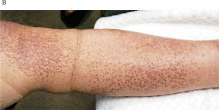
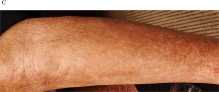
慢性閉塞性肺疾患注4)(まんせいへいそくせいはいしっかん、COPD: Chronic Obstructive Pulmonary Disease)の84歳の男性は、2018年8月、10月、11月の3回、自己脂肪由来幹細胞(ADSC)の静脈投与を受けました。彼の症状には、歩行中の息切れ、安静時の呼吸困難、夜間の痰などがありましたが、自覚症状は、1回目の投与後に改善し、2回目の投与後にさらに改善しました。予期せぬことに、最初のADSC投与の直後に、下肢のアミロイド沈着が減少しました(図1)。その後の皮膚アミロイドを追跡調査から、皮膚の色素沈着は衰退し続け(図2)、ADSCの最初の投与から2年後に沈着は目立たなくなりました(図3)。この観察期間中、アミロイドーシスに対する治療は行われませんでしたが、皮膚のアミロイド沈着は年月を経て徐々に改善していきました。患者に投与されたADSCは、CD10(CD10陽性はネプリライシンが発現していることを示します)、CD73、CD90、およびCD105に対して陽性であり、CD31、CD34、CD45、およびHLA-DRに対して陰性でした。
アルツハイマー病の潜在的な治療法としての間葉系幹細胞のネプリライシン以外の作用機序には以下の様な研究が報告されています。
- 炎症は、アルツハイマー病の脳で発生します。幹細胞には抗炎症作用があります8,9)。
- 幹細胞は、酸性線維芽細胞増殖因子、塩基性線維芽細胞増殖因子10)、インスリン様増殖因子、肝細胞増殖因子11)、顆粒球コロニー刺激因子、血管内皮増殖因子など、多くの増殖因子を分泌します。グリア細胞株由来神経栄養因子、脳由来神経栄養因子12)など。ストロマ細胞由来因子-α(SDF-1α)は血管新生および神経保護効果があることが示されています13,14)。それらはニューロンの修復に寄与する可能性があります15)。
- 幹細胞は血管新生を促進し、血流を改善します16)。その結果、脳機能を改善することができます。
- 幹細胞はニューロンに分化することができます17,18)。それらは、損傷したまたは死んだ神経細胞の代わりとして機能する可能性があります。
- 幹細胞は、アルツハイマー病病変のもう1つの特徴であるタウを分解して排除する可能性があります19)。しかし、幹細胞がそれを分解する酵素活性を持っているかどうかはまだわかっていません。
- 静脈内投与された幹細胞は、ホーミングとして知られる損傷または病変の部位に集まる傾向があります20)。
著者らは,結論として「自家脂肪由来幹細胞は、現在根本的な治療法がないアルツハイマー病の新しい治療法として有用である可能性があります。幹細胞はネプリライシンを分泌し、そのネプリライシンは脳内のアミロイド沈着物を分解し、神経の修復と再生を促進します。」とする仮説を提案しました。
(用語解説)
- 注1 アルツハイマー病(あるつはいまーびょう): アルツハイマー病は、脳内のアミロイド沈着症であると考えられています。 ネプリライシンはアミロイドβペプチドレベルを調節します。 ネプリライシン活性は、アルツハイマー病患者の脳、特にアミロイドが沈着している領域で低下します。 点滴で静脈内投与された間葉系幹細胞は、脳を再生するために使用できます。 幹細胞は脳内のアミロイド沈着部位でネプリライシンを分泌し、アミロイド沈着を排除する可能性があります。
- 注2 アミロイド(あみろいど): アミロイドは、コンゴーレッド染色でオレンジ色に染色され、偏光顕微鏡で緑色の偏光を示し、電子顕微鏡で7〜15nmの繊維構造を示す物質として定義されています。 アミロイドーシスという用語は、アミロイドが間質に沈着するあらゆる疾患を指すために使用されます。 ほとんどの場合、前駆体タンパク質であるアミロイド前駆体タンパク質(APP)は、折り畳み障害により重合し、ベータシート構造に富む不溶性フィブリルとして蓄積および凝集します。 それはアミロイドが沈着する器官によって特徴づけられ、全身性アミロイドーシスと限局性アミロイドーシスに大まかに分類されます。 限局性アミロイドーシスの中で、アミロイドが脳に沈着する状態は脳アミロイドーシスと呼ばれ、アルツハイマー病はその代表的な病気のひとつです。
- 注3 ネプリライシン(ねぷりらいしん): ネプリライシンは一般に5kDa以下のペプチドに作用し、ペプチドの疎水性アミノ酸残基のアミノ末端側でペプチド結合を切断します。 これは、アミロイドβの分解に関与する脳内の主要な酵素であり、アルツハイマー病の発症において中心的な役割を果たすことが期待されています。 これは、単量体のアミロイド-βだけでなく、より神経毒性のあるオリゴマーのアミロイド-βも分解できる唯一のペプチダーゼであると考えられています。
- 注4 慢性閉塞性肺疾患(まんせいへいそくせいはいしっかん、COPD: Chronic Obstructive Pulmonary Disease): 代表的な慢性呼吸器疾患の一つで、肺胞の破壊や気道炎症が起き、緩徐進行性および不可逆的に息切れが生じる病気です。多くの場合、咳嗽や喀痰も見られます。COPDの主要な原因は喫煙であり(間接的・受動的曝露を含む)、少数は大気汚染や職業病などによる、有毒なガスや微粒子の吸入です。日本名における慢性閉塞性肺疾患 (COPD) は通称「たばこ病」で、厚生労働省は以前「COPD」の名称として「たばこ病」や「肺たばこ病」を検討していました。2012年には世界で年間300万人がCOPDで死亡しており、これは世界における死因の6%を占めます。死者の90%以上は中低所得国です。2030年までに、COPDは世界3位の死因になるであろうとWHOは予測されています。(ウィキペディア(Wikipedia))
(参考資料)
- Selkoe DJ. Alzheimer disease and aducanumab: adjusting our approach. Nature Reviews Neurol 2019;15(7):365–6.
- Kumar D, Ganeshpurkar A, Kumar D, Modi G, Gupta SK, Singh SK. Secretase inhibitors for the treatment of Alzheimer’s disease: Long road ahead. Eur J Med Chem 2018;148:436–52.
- Marsh SE, Blurton-Jones M. Neural stem cell therapy for neurodegenerative disorders: The role of neurotrophic support. Neurochem Int 2017;106:94–100.
- Katsuda T, Tsuchiya R, Kosaka N, Yoshioka Y, Takagaki K, Oki K, et al. Human adipose tissue-derived mesenchymal stem cells secrete functional neprilysin-bound exosomes. Sci Rep 2013;3(1). https://doi.org/10.1038/srep01197.
- Katsuda T, Oki K, Ochiya T. Potential application of extracellular vesicles of human adipose tissue-derived mesenchymal stem cells in Alzheimer’s disease therapeutics. In: Stem Cell Renewal and Cell-Cell Communication. Springer; 2014. p. 171–81.
- Honmou O, Houkin K, Matsunaga T, Niitsu Y, Ishiai S, Onodera R, et al. Intravenous administration of auto serum-expanded autologous mesenchymal stem cells in stroke. Brain 2011;134(6):1790–807.
- Chang Y-W, Wu Y-C, Huang S-H, Wang H-MD, Kuo Y-R, Lee S-S. Autologous and not allogeneic adipose-derived stem cells improve acute burn wound healing. PloS one. 2018;13(5):e0197744.
- Iyer SS, Rojas M. Anti-inflammatory effects of mesenchymal stem cells: novel concept for future therapies. Expert Opin Biol Ther 2008;8(5):569–81.
- Kim Y-J, Park H-J, Lee G, Bang OY, Ahn YH, Joe E, et al. Neuroprotective effects of human mesenchymal stem cells on dopaminergic neurons through anti-inflammatory action. Glia 2009;57(1):13–23.
- Rehman J, Traktuev D, Li J, Merfeld-Clauss S, Temm-Grove CJ, Bovenkerk JE, et al. Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. Circulation 2004;109(10):1292–8.
- Ju G-q, Cheng J, Zhong L, Wu S, Zou X-y, Zhang G-y, et al. Microvesicles derived from human umbilical cord mesenchymal stem cells facilitate tubular epithelial cell dedifferentiation and growth via hepatocyte growth factor induction. PloS one. 2015;10(3):e0121534.
- Koh S-H, Kim KS, Choi MR, Jung KH, Park KS, Chai YG, et al. Implantation of human umbilical cord-derived mesenchymal stem cells as a neuroprotective therapy for ischemic stroke in rats. Brain Res 2008;1229:233–48.
- Askari AT, Unzek S, Popovic ZB, Goldman CK, Forudi F, Kiedrowski M, et al. Effect of stromal-cell-derived factor 1 on stem-cell homing and tissue regeneration in ischaemic cardiomyopathy. The Lancet 2003;362(9385):697–703.
- Shyu W-C, Lin S-Z, Yen P-S, Su C-Y, Chen D-C, Wang H-J, et al. Stromal cell-derived factor-1α promotes neuroprotection, angiogenesis, and mobilization/homing of bone marrow-derived cells in stroke rats. J Pharmacol Exp Ther 2008;324(2): 834–49.
- Imanishi J, Kamiyama K, Iguchi I, Kita M, Sotozono C, Kinoshita S. Growth factors: importance in wound healing and maintenance of transparency of the cornea. Progress in retinal and eye research 2000;19(1):113–29.
- Gnecchi M, He H, Liang OD, Melo LG, Morello F, Mu H, et al. Paracrine action accounts for marked protection of ischemic heart by Akt-modified mesenchymal stem cells. Nat Med 2005;11(4):367–8.
- Woodbury D, Schwarz EJ, Prockop DJ, Black IB. Adult rat and human bone marrow stromal cells differentiate into neurons. J Neurosci Res 2000;61(4):364–70.
- Guo L, Yin F, Meng H-Q, Ling L, Hu-He T-N, Li P, et al. Differentiation of mesenchymal stem cells into dopaminergic neuron-like cells in vitro. Biomedical and environmental sciences: BES 2005;18(1):36–42.
- Kim K-S, Kim HS, Park J-M, Kim HW, Park M-K, Lee H-S, et al. Long-term immunomodulatory effect of amniotic stem cells in an Alzheimer’s disease model. Neurobiol Aging 2013;34(10):2408–20.
- Lundberg J, S¨odersten E, Sundstr¨om E, Le Blanc K, Andersson T, Hermanson O, et al. Targeted intra-arterial transplantation of stem cells to the injured CNS is more effective than intravenous administration: engraftment is dependent on cell type and adhesion molecule expression. Cell Transplant 2012;21(1):333–43.
(adipocyte + neuron / 20210404)