
新たに承認されました再生医療等製品と、現在までの再生医療等製品の開発状況についてご紹介致します。
1.再生医療等製品について
わが国で再生医療等製品注1)の製造・販売に対しては、医薬品医療機器等法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)で規制されています。厚生労働省及び各都道府県の許可・承認を受けないと再生医療等製品を製造・販売することはできません。再生医療等製品の製造販売をおこなうための手順は、独立行政法人医薬品医療機器総合機構ウエブサイト1)1)にある「再生医療等製品 製造販売について」を参考にしてください。
2020年3月19日に、角膜上皮幹細胞疲弊症と脊髄性筋萎縮症を適応症とする再生医療等製品が薬事承認され、製造販売業者から保険収載を希望する旨の申出がなされています。
2.角膜上皮幹細胞疲弊症の治療用再生医療等製品2)
類別はヒト細胞加工製品(ヒト体性幹細胞加工製品)、一般名称はヒト(自己)角膜輪部由来角膜上皮細胞シートです。収載希望者は(株)ジャパン・ティッシュ・エンジニアリングです。販売名はネピックです。患者さん自身から採取しました角膜輪部組織から分離した角膜上皮細胞をシート状に培養して製造したヒト体性幹細胞加工製品です。角膜上皮幹細胞疲弊症注2)患者さんの眼表面に移植することにより、角膜上皮細胞が生着・上皮化し、角膜上皮を再建することを目的として使用されます。これによって、患者さん自身の健常眼から採取した角膜輪部を移植する従来の治療法では難しかった正常な角膜輪部が残存していない角膜上皮幹細胞疲弊症を治療することが可能となるとされています。
承認条件2)は次の通りです。
なお、本話題については、当センター「No.25 再生医療トッピクス 自家角膜上皮の製造販売を申請」でご紹介いたしております。また、「No.47 再生医療トッピクス iPS細胞から作製した角膜細胞、患者さんに移植、世界初」で角膜上皮幹細胞疲弊症に対する角膜細胞の移植について触れております。
3.脊髄性筋萎縮症に対する再生医療等製品2)
類別は遺伝子治療用製品(ウイルスベクター注4)製品)、販売名はゾルゲンスマ点滴静注です。収載希望者はノバルティスファーマ(株)です。当該製品は、脊髄性筋萎縮症(SMA)注5)の原因遺伝子であるヒトSMN遺伝子を搭載した非増殖性組換えアデノ随伴ウイルス(AAV)注6)を成分とする再生医療等製品です。当該製品が患者さんの運動ニューロンや筋細胞に感染し、当該製品に搭載された遺伝子発現構成体が細胞の核内にエピソーム注7)として留まり、ヒトSMN遺伝子は長期間安定して発現します。SMAの原因であるSMN1遺伝子の機能欠損を補い、発現したSMNタンパク質によって筋細胞の死滅を防ぎ、神経や筋肉の機能を高めることで、SMA患者さんの生命予後の改善が期待されます。脊髄性筋萎縮症の発症が予測される患者さんも含みますが、ただし、抗AAV9抗体注8)が陰性の患者さんに限るとされています。
承認条件2)は、以下の通りです。
4.再生医療等製品の開発状況2)
再生医療等製品の承認及び開発状況について「再生医療等安全性確保法の施行後5年を目処とした検討について3)」を参考にまとめました。
| 開発企業 | 品目 | 対象疾患 | 関係者 | 備考 |
|---|---|---|---|---|
| (株)ジャパン・ティッシュ・エンジニアリング | ジェイス(自家培養表皮) | 重症熱傷※1,先天性巨大色素性母斑※2,表皮水疱症※3 | 東邦大学医療センター大森病院 石河教授 | ※1 2007年10月29日承認 ※2 2016年9月29日承認 ※3 2018年12月28日承認 |
| ジャック(自家培養軟骨) | 膝関節軟骨損傷 | 2012年7月27日承認 | ||
| ネピック(自家角膜輪部由来角膜上皮細胞シート) | 角膜上皮幹細胞疲弊 | 大阪大学 西田教授 |
2020年3月19日承認 | |
| JCRファーマ(株) | テムセル(同種間葉系幹細胞) | 急性移植片対宿主病(GVHD)※1,表皮水疱症※2 | ※1 2015年9月18日承認 ※2 2019年3月22日承認申請 |
|
| テルモ(株) | ハートシート(自己骨格筋芽細胞由来細胞シート) | 重症心不全 | 大阪大学 澤教授 |
2015年9月18日承認 |
| ニプロ(株) | ステミラック(自己間葉系幹細胞) | 脊髄損傷 | 札幌医科大学 本望教授 |
2018年12月28日承認 先駆け審査指定品目 |
| ノバルティスファーマ(株) | キムリア(CAR-T療法) | B細胞性急性リンパ芽球性白血病、びまん性大細胞型B細胞リンパ腫 | 2019年3月26日承認 | |
| ゾルゲンスマ点滴静注(遺伝子治療用製品) | 脊髄性筋萎縮症 | 2020年3月19日承認 | ||
| アンジェス(株) | コラテジェン筋注用4mg | 慢性動脈閉塞症における潰瘍の改善 | 大阪大学 森下教授 |
2019年3月26日承認 |
| 未承認(再生医療) | ||||
| (株)日本再生医療 | 自家心臓内幹細胞 | 小児先天性心疾患の心機能改善 | 岡山大学 王教授 |
先駆け審査指定品目 |
| (株)セルシード | 口腔粘膜由来食道細胞シート | 表在性食道癌の術後創傷 | 東京女子医科大学 岡野教授 |
先駆け審査指定品目 |
| 大日本住友製薬(株) | 非自己iPS細胞由来ドバミン神経前駆細胞 | パーキンソン病 | 京都大学CiRA 高橋教授 |
先駆け審査指定品目 |
| (株)ヘリオス | ヒト(同種)成人骨髄由来多能性前駆細胞 | 急性期※1の脳梗塞 | 先駆け審査指定品目※1(発症後18~36時間) | |
| 大塚製薬(株) | NY-ESO-1・siTCR遺伝子治療/TBI-1301 | 滑膜肉腫 | 三重大学 珠玖教授 |
先駆け審査指定品目 |
| サンバイオ(株) | ヒト体性幹細胞加工品製品/SB623 | 外傷性脳損傷※1,慢性期脳梗塞 | ※1先駆け審査指定品目 | |
| 第一三共(株) | G47△ | 悪性脳腫瘍(神経膠腫) | 東京大学 藤堂教授 |
先駆け審査指定品目 |
| オンコリスバイオファーマ(株) | OBP-301(テロメライシン) | 局所進行性食道がん | 先駆け審査指定品目 | |
5.再生医療等技術の保険収載までの手順
再生医療等技術の保険収載までの手順を「再生医療等安全性確保法の施行後5年を目処とした検討について3)」を参考に図解しました。
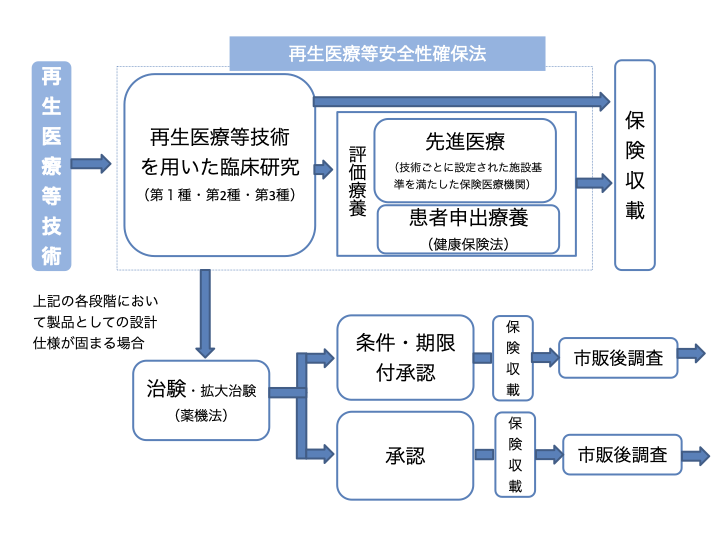
図1 再生医療等技術の保険収載までの手順3)
(用語解説)
(参考資料)
(NPO法人再生医療推進センター 守屋好文)
プライバシーポリシー
再生医療推進センターは再生医学、再生医療の実用化を通して社会への貢献を目指す非営利活動法人です。
Copyright © NPO法人再生医療推進センター All rights reserved.