1.はじめに
世界で腎移植などを必要とする患者さんは530万人~1050万人と推計(国際腎臓学会(ISN):2018年7月公表)され、またわが国で2017年の腎臓移植希望登録数の約12,500件に対して、腎臓移植例は約1,750件と報告(日本移植学会:2019年1月公表)されています。人工透析患者数は339,841人でした(わが国の慢性透析療法の現況、日本透析医学会:2018年12月31日)。
研究者の方々は、安心して誰もが治療を受けられる再生医療技術を確立し、腎不全患者さんを人工透析の負担から解放することを目指されています。腎臓移植は、腎不全患者に対する有効な治療法であるものの、慢性的なドナー不足という社会的課題があります。この問題解決へ向けて、試験管内でヒトiPS細胞から腎臓を作製する試みがなされていますが、立体的、かつ移植に適したサイズの腎臓を作製するまでには至っていません。
2006年に京都大学山中教授がiPS細胞の作製に成功して以来、再生医療に応用する研究は大きく進展しています。2019年5月5日現在、網膜、角膜、心筋、血液、神経、膝軟骨など様々な組織や臓器を構成する細胞が作製され、臨床研究および治験が行われています。ただし、細胞や組織は臓器という立体的なものの一部です。そのため、立体的な臓器をつくる試みもなされており、ミニ肝臓を作成し、臨床研究が開始されました(当センターウエブサイト、再生医療トピックス:No.20再生医療トッピクス iPS細胞からミニ肝臓 重篤な肝臓病の乳児に移植する臨床研究)。同ミニ肝臓の研究に基づいてiPS細胞から肝臓と胆管、膵臓を同時に作製することに世界で初めて成功したという研究も紹介致しました(当センターウエブサイトNo.52再生医療トッピクス iPS細胞からミニ多臓器の作製に成功)。
腎臓は、立体的な臓器の中でも最も再生が難しい臓器とされています。腎臓の再生医療についてですが、iPS細胞に期待が寄せられています。iPS細胞による臓器再生ロードマップ1)(2015年11月11日改訂版)では、腎尿路系として、腎臓は以下の通りに計画されています。
2020年5月5日現在、厚生労働省に届出されている再生医療等提供計画2)には、腎臓疾患に関する提供計画としては、第二種再生医療等・研究で、「急性腎不全に対する自家末梢血CD34陽性細胞移植治療注1):医療法人沖縄徳洲会湘南鎌倉総合病院」があります。また、第二種再生医療等・治療では「慢性腎臓病(CKD)に対する自家脂肪由来間葉系幹細胞注2)を用いた治療:北青山Dクリニック」があります。なお、慢性腎臓病などに対する再生医療等の取組については、当センターウエブサイト、No.43再生医療トピックス(1)、No.44再生医療トピックス(2)、No.45再生医療トッピクス(3)で紹介致しております。
2.ヒトiPS細胞から腎組織
2.1 ヒトiPS由来の腎臓細胞 マウス移植
熊本大学の西中村教授らの研究グループは、ヒトのiPS細胞から作製した腎臓組織の元となる細胞をマウスに移植し、血管とつなげて成長させることに成功したと発表しました(2015年11月27日)3)。同グループは2013年、ヒトのiPS細胞を分化させ、血液から尿をろ過する糸球体と、糸球体から伸びて水分や栄養分を再吸収する管状の尿細管を試験管内で作り出していました。作り出された糸球体が血管とつながっていないために未成熟な部分が多く、生体内で機能できるのかどうか定かではありませんでした。発表された研究では、糸球体と尿細管に分化する手前段階にある細胞をマウスの腎臓に移植すると、同細胞はマウスの体内で成長し、血管を取り込みながら糸球体を形成したそうです。その後、血液から尿をろ過する膜も形成され、ろ過したことで生じたとみられる物質も確認され、尿細管も確認されました。
その後、同西中村教授及び谷川助教らの研究グループは、ヒトiPS細胞から誘導した腎臓前駆細胞注3)を試験管内で増やす方法を開発したと発表しました(2019年7月26日)4)。同研究グループはヒトiPS細胞から作成した腎臓前駆細胞を試験管内で増やす際にアクチビン注4)が有効であることを見出しました。加えて、増やした腎臓前駆細胞は凍結保存することができ、融解後も腎臓組織を形成する能力を有していることを明らかにしました。今後、患者由来iPS細胞から作成した腎臓組織の病態解明や創薬の研究、腎臓組織を再構築する再生医療に結びつくとことが期待されます。
2.2 ヒトiPS細胞から腎組織を再生
腎臓の主な働きは、血液をろ過し、尿を作ることです。その機能を担うのは腎臓の中のネフロン注5)注呼ばれる組織です。ネフロンは、糸球体という毛細血管の塊から血液をろ過する構造とそこに繋がる尿細管で構成され、集合管注6)つながります。これまでの研究で、腎臓は主に2種類の腎前駆細胞である後腎ネフロン前駆細胞(NP)と尿管芽(UB)の相互作用により形成されることが解明されていました。ただ、ヒトiPS細胞から別個に分化誘導されたそれぞれの腎前駆細胞から腎組織を作製することは難しく、分化培養システムを確立する必要がありました。
京都大学iPS細胞研究所の長船教授らチームが、次の研究成果を発表しました5)。ヒトiPS細胞から後腎ネフロン前駆細胞と尿管芽それぞれに分化する培養システムを構築することに成功し、培養皿上で糸球体、尿細管などのネフロンの特徴を持った組織と集合管を連結させたヒトの腎組織を作製することに初めて成功しました。さらに、拒絶反応を示しにくい免疫不全マウスの腎臓被膜下のスペースに移植した腎組織が血管とつながることを確認しました。腎組織は糸球体、尿細管、集合管などを含んでいることが判明し、尿細管と集合管は連結していることも確認できたとしています。つながった血管が実際に機能しているか調べるため、多光子励起顕微鏡注7)を用い、移植後10日経過した生きた状態のマウスの腎臓を観察すると、赤色蛍光色素で造影した血流が移植した腎組織に入り、糸球体を通っていることが動画で確認できたとのことです。
作製された腎組織はまだ小さく透析療法が必要になる患者さんの体内に移植して尿を作るなどの機能は難しいとのことですが、本研究の成果は腎臓の再生医療に必要となる細胞の供給給法として期待されます。
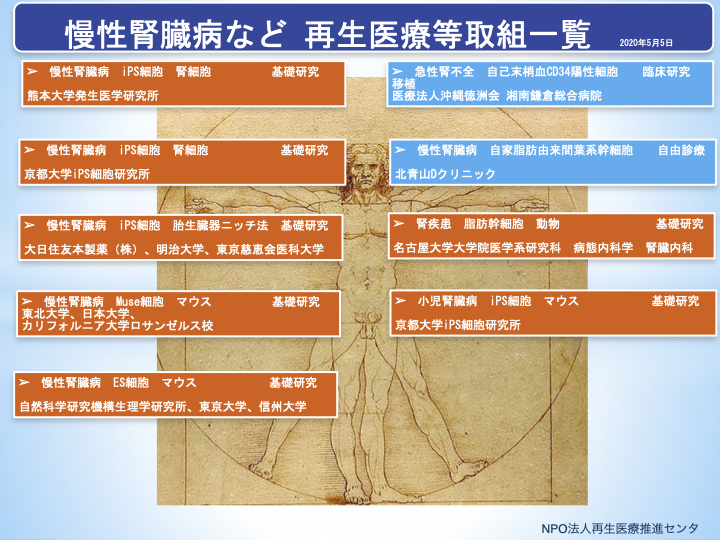
図1 慢性腎臓病等に対する再生医療等の取組
(用語解説)
(参考資料)
(NPO法人再生医療推進センター 守屋好文)